Quote:
Originariamente inviato da zanardi84
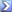
Risolto: in questo caso S non rispetta la regola dell'ottetto, ma vuole 10 elettroni attorno.
Ora ho un altro problema: ho la molecola C3H4, idrogeni alle estremitā legati ognuno con un legame semplice al carbonio. I tre atomi di carbonio sono legati tra loro con doppi legami.
Come stabilisco se gli idrogeni stanno tutti sullo stesso piano?
Intanto ho notato che il C centrale č ibridizzato SP, mentre quelli periferici (CH2) sono ibridizzati SP2.
Grazie.
|
Gli idrogeni NON stanno tutti sullo stesso piano!
Se il carbonio centrale e' ibridato sp (giusto!), allora i due orbitali p rimanenti staranno su piani ortogonali uno rispetto all'altro. Ognuno di questi due p non ibridizzato andra' a fare un legame doppio con il p non ibridizzato dei C terminali. L'orbitale sp2 si trova a sua volta ortogonale al p non ibridizzato, quindi alla fine ti trovi i due sp2 su due piani ortogonali fra loro.
Si fa prima a disegnarlo.
